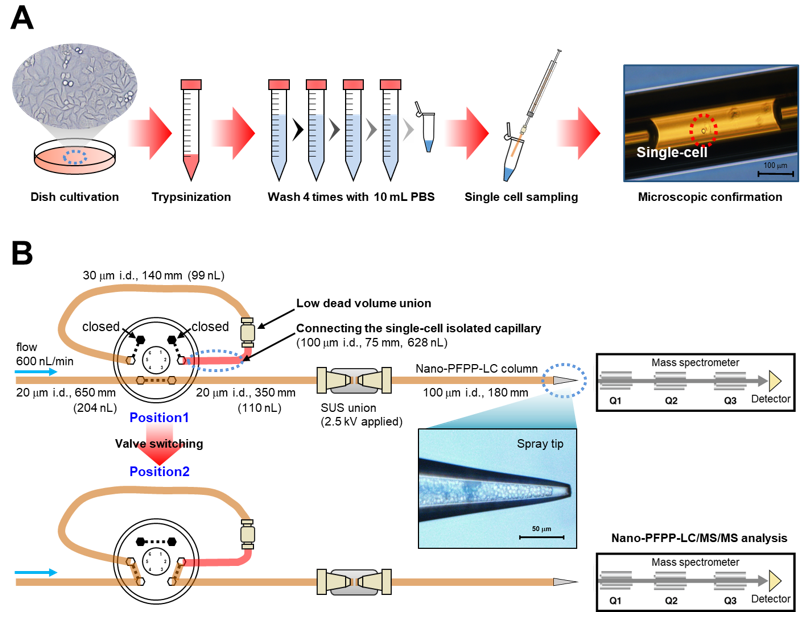
代謝物はDNAやRNA解析時のPCRのような増幅操作ができないため、細胞内に存在する分子をそのまま検出する必要があります。他の分子階層 (プロテオーム・トランスクリプトームなど) と比べると、代謝物は比較的高濃度 (microM–mM) で存在するものも多いものの、生物種の細胞サイズは大きく異なります。例えば、アフリカツメガエルの初期胚では、細胞直径が1 mm、体積が523 nLであり、1 mMの濃度の代謝物は1細胞あたりに523 pmol含まれます。一方、HeLa細胞のような典型的な動物細胞では、細胞直径が20 microm、体積が4 pLであり、1 mMの濃度の代謝物でも1細胞あたりの絶対量としては4 fmolしか存在しません (アフリカツメガエルの初期胚と比べると約100,000倍少ない)。1細胞分析の難易度は細胞サイズにより大きく異なると言えます。典型的な動物細胞のシングルセルメタボロミクスを行うには分析系の感度向上が必要です。
一般的なLC/MSの高感度化の方法として、カラム内径の微小化する方法があります。エレクトロスプレーイオン化質量分析計 (ESI-MS) は濃度依存的な検出器であるため、得られるシグナルは、最大ピーク濃度 (Cmax) に依存します。ここでCmaxとはキャリアフローにおける化合物の最大濃度を示します。理論的にはCmaxに影響を与える最も重要なパラメーターはカラム内径であるため、流速を下げて内径の小さなカラムを用いることにより、LC/MSの感度を高めることができます (図1)。さらに、流量が減少すると、ESIからより微細な液滴が放出され、気化効率が向上することでイオン化が促進されます。また、ESIニードルをイオン取り込み口であるオリフィスへ近づけることによりイオン導入効率が向上し、結果として感度向上が見込めます。しかしながら、メタボロミクスでは、カラム内径を微小化したnano-LC/MSの代謝解析への適用例は少なく、さらに、HeLa細胞のような典型的な動物細胞の1細胞メタボロミクスへの適用事例はありません。そこで、本研究では、カラム内径のダウンサイジングにより高感度なnano-LC/MSシステムを構築し、HeLa細胞のシングルセルメタボロミクスをnano-LC/MSにより実行可能であるかを検証することを目的と設定しました。
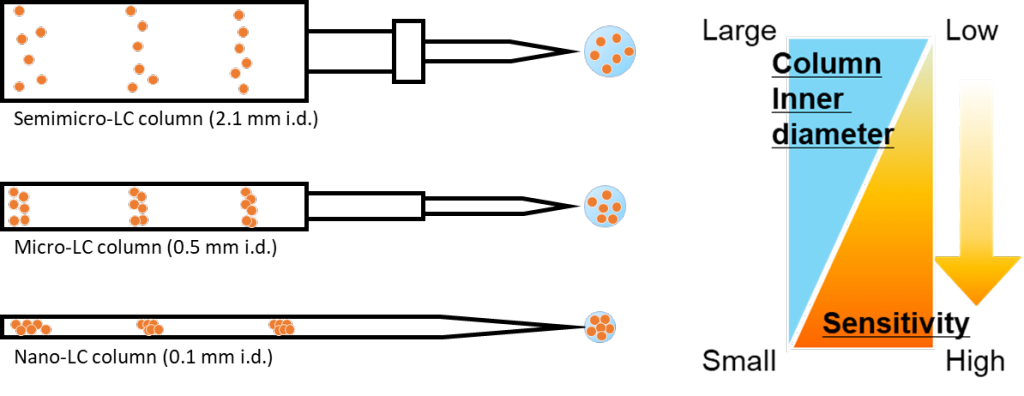
図1.LCカラムの内径とLC/MSの感度の関係
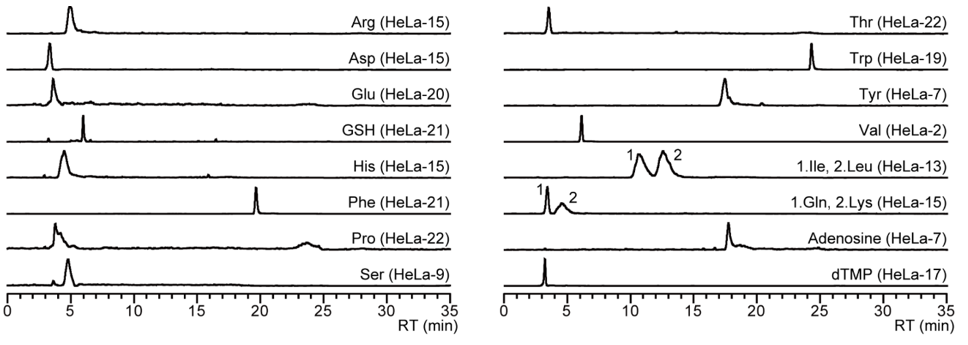
Pentafluorophenylpropyl (PFPP) カラムは親水性代謝物に良好な分離性能を示す逆相カラムとして利用されています。まず、キャピラリーレーザープラーを用いて、フューズドシリカキャピラリーを加熱切断してナノスプレイヤーチップ (内径100 microm,先端径8-10 microm) を作製しました。これに市販PFPPカラムで使用されているPFPP粒子を充填し、内径100 micromのPFPP-nano-LCカラムを自作し、nano-PFPP-LC/MSシステムを構築しました。 構築した分析法では、良好なピークエリア値の再現性 (RSDs, <16%; average RSDs, 7.2%)、直線性 (R2, > 0.980) が得られました。また、10種の代謝物 (phenylalanine, valine, UMP, proline, histidine, tryptophan, GMP, CMP, leucine, and glutamic acid) において、fmol以下 (20−950 amol) の検出感度を達成していることが確認されました。そして、PFPP-nano-LC/MS/MSにより1細胞メタボローム分析を実施した結果、単一HeLa細胞 (n = 22) から合計18種の代謝物を同定することに成功しました (図2).
図2.単一HeLa細胞から同定された代謝物
次に、検出された代謝物が22個の単一HeLa細胞間でどれくらい異なるかを調べました。まず、22個の単一HeLa細胞で得られたtryptophanのクロマトグラムを図3にまとめました。全ての単一HeLa細胞 (n = 22) からtryptophanを検出することができている様子が確認できます。驚くべきことに、均一に見える細胞集団の中にも、tryptophan量の少ない細胞と多い細胞では、最大で約10倍程度もの量的な違いがあることが確認できました。細胞は代謝レベルで不均一性を有していることが示されました。
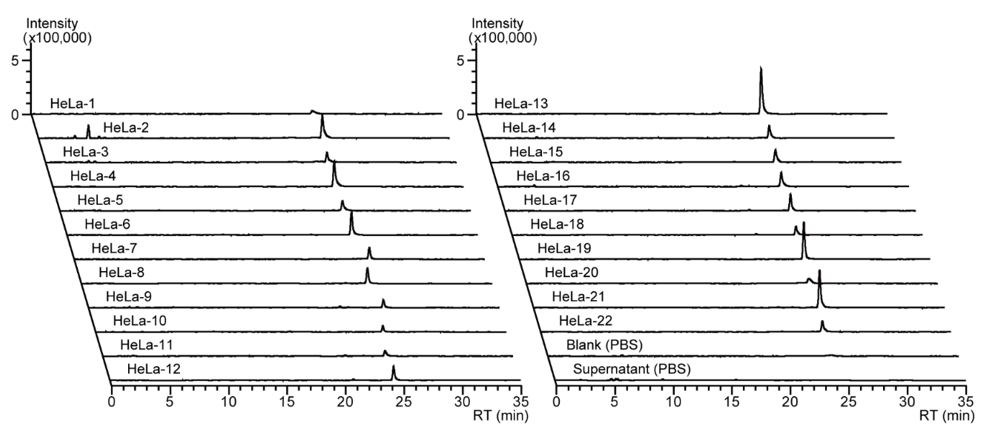
図3.細胞の代謝ヘテロ性の例 (tryptophan)
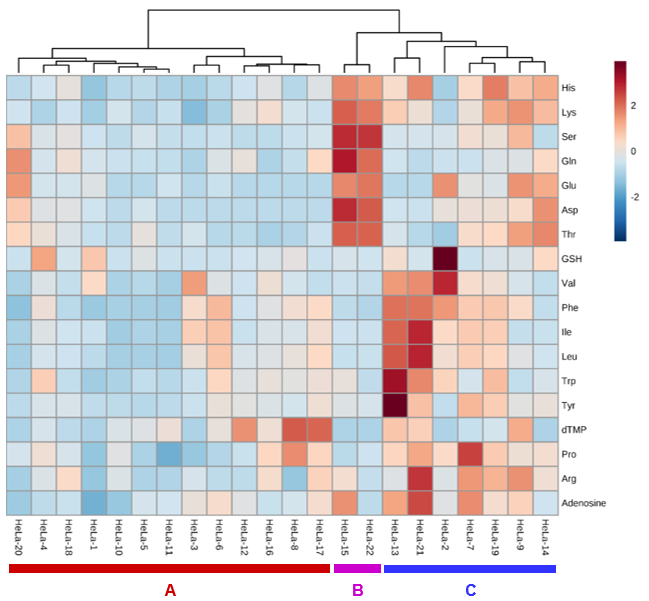
また、検出された全ての代謝物ピークエリア値を用いて階層クラスター解析を行ったところ、分析した22個の単一HeLa細胞は、代謝の類似度に基づいてクラスター (A、B、C) に分類されました (図4)。例えば、 “HeLa-15” と “HeLa-22” のように、類似した代謝物パターンを示す細胞が存在していたことが分かります。これらの結果から、培養HeLa細胞集団においても、いくつかのサブクラスが存在していることが示唆されました。今回の培養細胞を用いた1細胞メタボローム分析結果により分類されたサブクラスは細胞状態の違い、例えば細胞周期の違いあるいはその他のこれまでに知られていない代謝機能の違いを捉えている可能性が考えられます。今回、我々が開発したシングルセルメタボローム分析手法はこうした細胞状態の違いを高解像度に観測できる手法です。今後、開発した手法を様々なシングルセルメタボロミクス研究に応用していきたいと考えています。
図4.単一HeLa細胞の階層クラスター解析の結果
参考
・Kohta Nakatani, Yoshihiro Izumi, Kosuke Hata, Takeshi Bamba, Mass Spectrom, A0080, 9 (1), 2020
・和泉自泰,中谷航太,秦康祐,原健士,松本雅記,馬場健史,J. Mass Spectrom. Soc. Jpn.,Vol. 68, No. 2, 2020
・本研究は2018年5月に開催された 日本質量分析学会・日本プロテオーム学会2018年合同大会にて最優秀賞を受賞しました
・本研究は2018年8月に開催された第21回生医研リトリートにて優秀口演賞を受賞しました
・本研究は2018年10月に開催された第13回生命医科学研究所ネットワーク国際シンポジウム/トランスオミクス医学研究拠点ネットワーク形成事業 第3回シンポジウム/第28回ホットスプリングハーバー国際シンポジウム合同開催にてEarly Carrier Investigator Awardを受賞しました