脂質は糖質やタンパク質と並んで三大栄養素と呼ばれ、生体膜の主要構成成分、エネルギー源、神経伝達や生体防御の調節など、生命維持や身体活動に欠かすことができません。脂質はアルコール (グリセリン、スフィンゴシン、ステロール) に様々な種類の脂肪酸がエステル結合あるいはアミド結合するため、理論的には数万種類の脂質分子が存在すると言われています。こうした脂質分子の質の違いが種々の疾患に関与することが示唆されており、脂質の生物学的機能や代謝制御を理解するためには個々の脂質分子の識別と定量が必要不可欠です。実際、個々の脂質分子を包括的かつ定量的に観察するリピドミクスが医学研究など様々な研究分野で注目されています。
生体内の脂質分子は極性頭部と脂肪酸側鎖の多様性に伴い膨大な種類が存在するため、これらの脂質分子を包括的かつ精確に測定するには高度な分析技術が必要です。エレクトロスプレーイオン化質量分析計 (Electrospray ionization mass spectrometer, ESI-MS) はイオン化した化合物を一斉測定することが可能な装置で、化合物を溶出時間の違いで分離する各種クロマトグラフと連結することが可能です。一方、ESI-MSにおける最大の問題点として、目的の化合物と同時溶出する夾雑物によりイオン化が抑制されることが挙げられます。クロマトグラフの分離条件の違いにより目的の化合物と同時溶出する夾雑物が異なるため、研究施設ごとに全く異なる定量値が算出されてしまい、データの蓄積を行うことができませんでした1)。馬場研究室では、クロマトグラフと質量分析計の分離分析条件を最適化することで、生体内の脂質分子を包括的に定量可能な新規分析法を新たに開発しました2) (図1)。
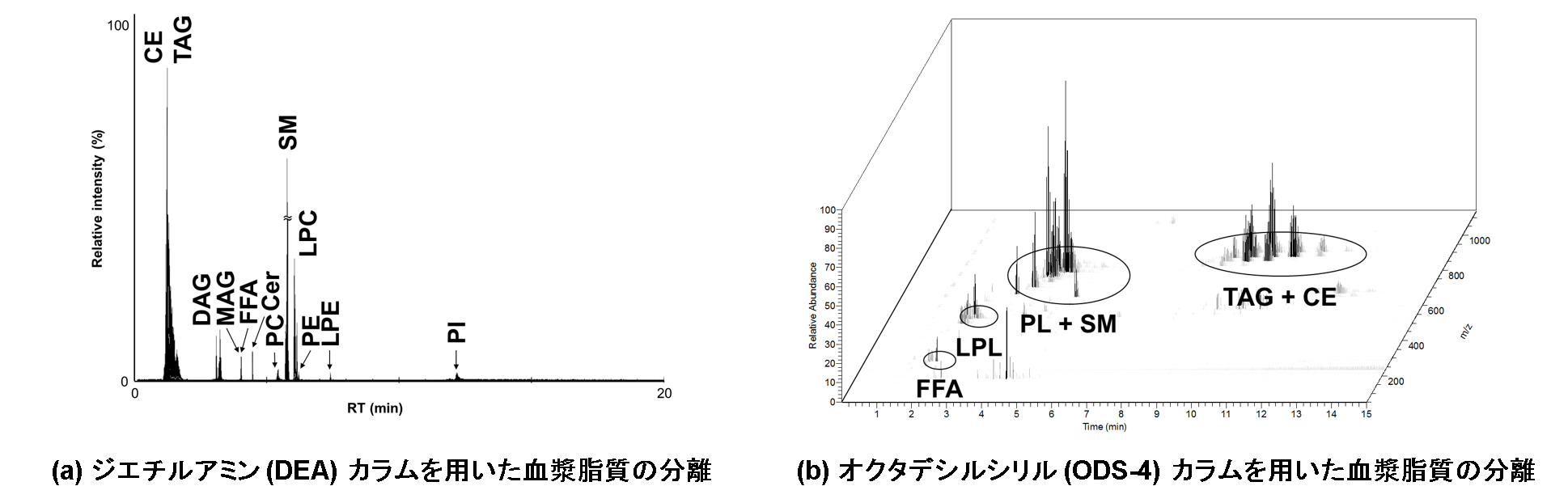
ESI-MSを用いて定量するためには、各脂質分子に対応する内部標準物質を添加し,それぞれのイオン化の抑制を補正しなければなりませんが、全ての脂質分子の内部標準物質を揃えることは事実上不可能です。まず我々は脂質合成標準品を用い、同じ脂質クラス (グリセロールなどの骨格やホスホコリンなどの極性頭部が共通した脂質分子) は同程度の効率でイオン化することを確認しました。そこで、超臨界流体クロマトグラフ (Supercritical fluid chromatograph, SFC) により各脂質クラスを溶出時間の違いで分離可能な条件を最適化し、脂質クラスごとに生体内に存在しない内部標準物質を添加して測定しました。その結果、全ての脂質クラスにおいて64.9%から103.5%の精度で定量値を算出可能であることが示されました。また、ほとんど全ての脂質クラスにおいて日間誤差が10%以内におさまり,定量面の問題を克服することができました。
クロマトグラフにより同じ脂質クラスを同時溶出させる場合,同一クラスの脂質分子の分離は質量分析計に頼らざるを得ません。そこで我々は三連四重極型質量分析計 (Triple quadrupole mass spectrometer, QqQ-MS) の多重反応モニタリング (Multiple reaction monitoring, MRM) モードによる分離を適用しました。MRMモードでは、イオン化した脂質分子を選択し、不活性化ガスにより開裂した後、開裂したフラグメントをさらに選択することで検出します。個々の脂質分子から開裂した構成脂肪酸由来のフラグメントを検出することで、構造異性体を含めた個々の脂質分子の識別を達成することができました (図2)。
MRMモードでは測定対象とする化合物を事前に決定しなければなりません。本分析法をあらゆる生体試料に適用するため、生体内の脂質分子を包含したin-house脂質MRMライブラリを作成しました。まずin-house脂質MRMライブラリを用いて生体試料に含まれる脂質分子をスクリーニングします。検出された脂質分子を対象としてMRMメソッドを再構築することで、あらゆる生体試料の脂質定量分析を実現することに成功しました。本手法は様々な共同研究においても活用されており、今後新たな生命機能の解明の一端を担うことが期待されます。
参考文献
- J. A. Bowden, A. Heckert, C. Z. Ulmer, C. M. Jones, J. P. Koelmel, L. Abdullah, L. Ahonen, Y. Alnouti, A. Armando, J. M. Asara, T. Bamba, J. R. Barr, J. Bergquist, C. H. Borchers, J. Brandsma, S. B. Breitkopf, T. Cajka, A. Cazenave-Gassiot, A. Checa, M. A. Cine, R. A. Colas, S. Cremers, E. A. Dennis, J. E. Evans, A. Fauland, O. Fiehn, M. S. Gardner, T. J. Garrett, K. H. Gotlinger, J. Han, Y. Huang, A. H. Neo, T. Hyotylainen, Y. Izumi, H. Jiang, H. Jiang, J. Jiang, M. Kachman, R. Kiyonami, K. Klavins, C. Klose, H. C. Kofeler, J. Kolmert, T. Koal, G. Koster, Z. Kuklenyik, I. J. Kurland, M. Leadley, K. Lin, K. R. Maddipati, D. McDougall, P. J. Meikle, N. A. Mellett, C. Monnin, M. A. Moseley, R. Nandakumar, M. Oresic, R. E. Patterson, D. Peake, J. S. Pierce, M. Post, A. D. Postle, R. Pugh, Y. Qui, O. Quehenberger, P. Ramrup, J. Rees, B. Rembiesa, D. Reynaud, M. R. Roth, S. Sales, K. Schuhmann, M. L. Schwartzman, C. N. Serhan, A. Shevchenko, S. E. Somerville, L. St. John-Williams, M. A. Surma, H. Takeda, R. Thakare, J. W. Thompson, F. Torta, A. Triebl, M. Trotzmuller, S. J. K. Ubhayasekera, D. Vuckovic, J. M. Weir, R. Welti, M. R. Wenk, C. E. Wheelock, L. Yao, M. Yuan, X. H. Zhao, S. Zhou: Harmonizing Lipidomics: NIST Interlaboratory Comparison Exercise for Lipidomics using Standard Reference Material 1950 Metabolites in Frozen Human Plasma. J. Lipid Res. 58. 2275‒2288 (2017).
- H. Takeda, Y. Izumi, M. Takahashi, T. Paxton, S. Tamura, T. Koike, Y. Yu, N. Kato, K. Nagase, M. Shiomi, T. Bamba: Widely-targeted quantitative lipidomics method by supercritical fluid chromatography triple quadrupole mass spectrometry, J. Lipid Res. 59. 1283‒1293 (2018).
